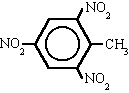
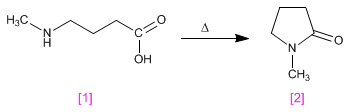
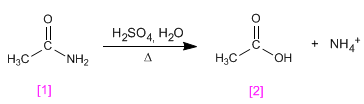
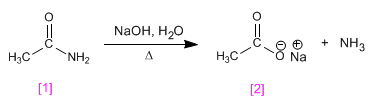
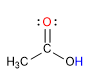
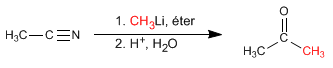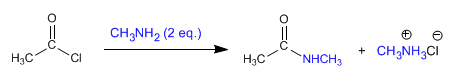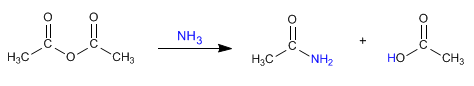l Listerine fue bautizado así en honor al cirujano británico sir Joseph Lister, que en el siglo XIX introdujo drásticas medidas sanitarias en los quirófanos. Pero su creador fue otro médico, Joseph Lawrence, de Missouri, que lo presentó en 1880 y acabó siendo en uno de los productos más usados para enjuagues y gárgaras.
Lister denunció en la década de 1860 las condiciones de higiene médica entre los cirujanos. Éstos operaban con las manos desnudas y con ropa de calle, y calzados con los mismos zapatos que habían pisado las vías públicas y los pasillos del hospital.
Para taponar las heridas usaban serrín recogido de los suelos de las fábricas.
Aunque los instrumentos quirúrgicos se lavaban con agua y jabón, no se esterilizaban térmicamente ni se sometían a la acción de desinfectante químico alguno.
Bajo estas condiciones, no es de extrañar que en los hospitales la mortalidad postoperatoria llegara al 90 %.
La comunidad médica, pues, reaccionó de manera recelosa ante los discursos de Lister acerca de la cirugía aséptica y los gérmenes. Pero Joseph Lawrence quedó impresionado y, finalmente, en su laboratorio de St. Louis, preparó un líquido antibacteriano que fue fabricado por la Lambert Pharmacal Company.
Fue vendido como antiséptico quirúrgico y luego como desodorante, loción anticaspa y loción para después de afeitar. Incluso se usó para fregar suelos. Pero el gran éxito de Listerine llegó cuando empezó a venderse como enjuague bucal.
Se aseguraba que gargarismo y enjuague bucal, “mataba gérmenes a millones por simple contacto”, y millones de americanos compraron el producto. En los primeros anuncios aparecía un solterón, Herb, “un excelente muchacho, poseedor de algún dinero”, que también “juega bastante bien al bridge”. Sin embargo, el problema de Herb, según el anuncio, consistía en que “él es así”.
El problema de Herb era la halitosis, y los americanos se acostumbraron a usar Listerine para aromatizar su aliento.
Sin embargo, Listerine fue desmentido médicamente un puñado de años más tarde. Una orden judicial de 1970 obligó a la Warner_Lambert a gastar diez millones de dólares para manifestar públicamente que el Listerine no podía prevenir un resfriado ni una faringitis, ni tampoco reducir su intensidad.